La mole est l'unité de quantité de matière, notée n. Une mole d'atomes, ions ou molécules contient 6,02 × 1023 atomes, ions ou molécules. La constante d'Avogadro est NA = 6,02 × 1023 mol-1. La masse molaire atomique M d'un échantillon est la masse d'une mole de cet élément. Comment calculer la masse d'un noyau seconde ? La masse d'un noyau d'atome peut être calculée en additionnant la masse de tout ses composants: les neutrons et les protons.
Comment calculer la masse du carbone 14 ?
Le carbone 14, noté 14C, est l'isotope du carbone dont le nombre de masse est égal à 14 (c'est un isobare de la forme la plus commune de l'azote) : son noyau atomique compte 6 protons et 8 neutrons avec un spin 0+ pour une masse atomique de 14,003 241 99 g/mol .
Comment faire la datation au carbone 14 ? La méthode repose sur la présence de radiocarbone dans tout organisme vivant, une présence qui décroît ensuite de façon exponentielle à partir de la mort de l'organisme. Il suffit alors de mesurer le rapport entre le carbone 14 et le carbone restant (14C/C total) pour retrouver l'âge de l'organisme.
Quelle est l equation de désintégration carbone 14 ?
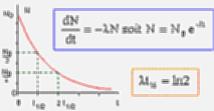
On note l la constante radioactive du carbone 14. On note N(t) le nombre de noyaux radioactifs présents à l'instant t dans l'échantillon. L'activité d'un échantillon radioactif A(t) est le nombre de désintégrations qu'il produit par unité de temps soit A(t) = -dN(t) / dt. Pourquoi 12 g de carbone 12 ? Pour constituer un système de 12 grammes de carbone 12, il faut 602 200 000 000 000 000 000 000 atomes de carbone, soit 6,022 x 1023. Ce nombre est appelé nombre d'Avogadro. RETENIR : une mole est la quantité de matière d'un système contenant autant d'entités élémentaires qu'il y a d'atomes dans 12 g de carbone 12.
Pourquoi 6 02 10 23 ?
6.02x10*23 molécules de carbone c'est une mole de carbone. Oui, à ceci près que le carbone (pur) est constitué d'atomes de carbone et non de molécules. Il faudrait dire : "Une mole (d'atomes) de carbone correspond à 6,02x1023 atomes de carbone." C'est quoi un atome de carbone ? L'atome de carbone est l'élément de base des molécules étudiées en chimie organique et en biochimie. On peut voir sur les représentations ci - dessus que l'atome de carbone possède quatre électrons sur sa couche électronique la plus externe.
Quel est le nombre de masse A de cet atome ?
Le nombre de masse (A ) correspond à la somme du nombre de neutrons et de protons qui constituent le noyau d'un atome. Un atome d'azote 14 (14N) est composé de 7 protons, 7 neutrons et 7 électrons. Son numéro atomique (Z) est 7 puisqu'il possède 7 protons.
Comment trouver N avec m et V ? Si on a une espèce liquide, on n'aura souvent pas la masse mais le volume. On reprend la formule : n=mM. Et puisqu'on n'a pas la masse mais le volume on va « convertir » la masse en volume en utilisant la masse volumique : ρ=mV. On obtient alors la formule : n=ρ×VM.
